
非小细胞靶向药物前景如何?
2017-09-06 作者:
肺癌是我国死亡率和发病率均排名第一的恶性肿瘤疾病,根据国家癌症中心2015年的统计数据,我国每年新发肺癌病例约为70万。据商业情报供应商 GBI Research称,全球非小细胞肺癌治疗市场规模将从2014年的69亿美元增长到 2021年的109亿美元。而中国抗肺癌药物市场规模早已超过200亿元。
肺癌主要分为非小细胞癌和小细胞癌两大类型,其中,非小细胞癌(NSCLC)占85%以上。随着分子生物学的发展,多种基因突变与表达异常等分子机制被证实与NSCLC的发病、耐药相关。目前,多种分子靶向治疗药物已投入临床使用或正在进行临床试验。狭义上讲,肺癌的靶向治疗就是在细胞分子水平上,针对这些驱动基因开发靶向药物,定点抑制致癌分子,灭杀肿瘤细胞。近十年来,分子靶向治疗在具有驱动基因的晚期非小细胞肺癌患者中取得显著疗效,其中,最具代表性的是针对表皮生长因子受体(EGFR)和ALK基因重排的靶向治疗。
本文将主要探讨国内外已上市及在研的靶向EGFR基因突变、ALK基因重排的分子靶向药情况,欢迎指正。
一、 行业概述
1、NSCLC靶向治疗靶点
2016年,Oncotarget杂志发表的关于1770位中国非小细胞肺癌患者大规模基因检测结果显示约69%的NSCLC患者携带驱动基因突变。其中约58%的NSCLC患者可接受已上市药物的靶向治疗并从中获益。
中国非小细胞肺癌靶点分布:
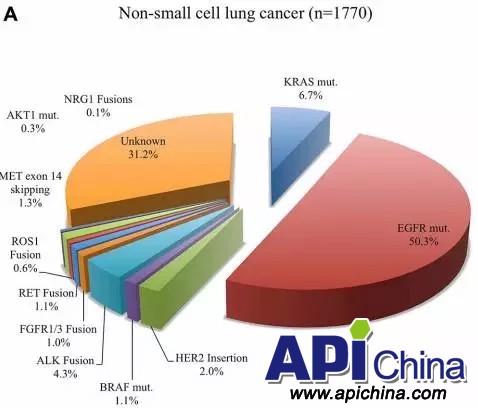
资料来源:Oncotarget.2016 Jul 5;7(27):41691-41702
肺腺癌 ( lung adenocarcinoma )是肺癌的一种,属于非小细胞癌,占NSCLC的50%以上。下图统计了肺腺癌相关的异常基因及其在肺腺癌中的发生率。目前靶向EGFR和ALK基因的分子靶向药物可以治疗约25%肺腺癌患者,仍有大量肺腺癌患者携带的基因突变无法通过分子靶向药物治疗,包括KRAS突变以及未知突变。
肺腺癌靶点分布:
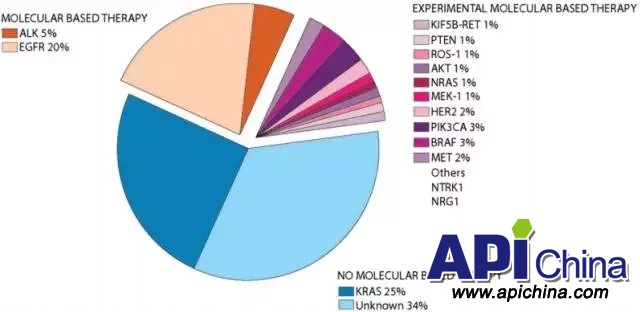
资料来源:Chest. 2014 Dec;146(6):1649-1657
2、酪氨酸激酶抑制剂靶点
最早被FDA批准的治疗肺腺癌的靶向药物靶点为EGFR的酪氨酸激酶区突变者与ALK重排者。两种药物通常被称为酪氨酸激酶抑制剂(以下简称TKI)。其靶点情况具体如下:
(1) EGFR突变
EGFR 突变是 NSCLC 最常见的驱动基因,大约20%的肺腺癌患者发生EGFR突变,约10%的高加索NSCLC患者和30-40%的东亚NSCLC患者存在EGFR突变,EGFR突变在不吸烟肺腺癌患者中发生率较高。多数突变发生在EGFR激酶区的18-21号外显子(表1)。
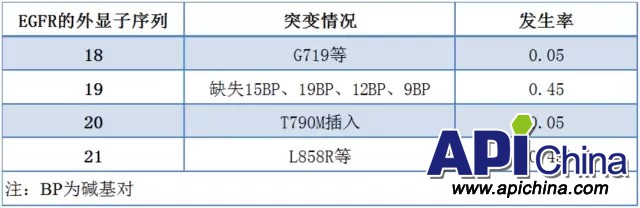
表1 EGFR的主要突变情况
最常见的两种EGFR突变为19号外显子缺失(编码E746-A750的15个碱基对缺失)和21号外显子的突变L858R,在TKI敏感的腺癌中,占约90%。其它对TKI敏感的突变有21号外显子L816Q,18号外显子G719X。20号外显子T790M突变与TKI原发、继发耐药有关,此外,TKI原发耐药与KRAS突变和ALK基因重排相关,继发耐药与组织学转化(NSCLC转化为SCLC、EMT)有关。另一个耐药机制是MET扩增,通过ERBB3信号导致了PIK3CA/AKT 通路激活,出现在大约1%-2%的肺腺癌患者中,为5% -20%的TKI耐药负责。肿瘤中的其它基因相互作用,比如EGFR信号通路的下游基因的突变,HER2扩增,也导致TKI耐药。
(2) ALK重排
EML4-ALK融合基因发生于接近5%的肺腺癌患者中,导致被EML4编码的蛋白的N端和被ALK编码的受体酪氨酸激酶的跨膜信号部分融合。ALK的激活导致细胞增殖、存活、迁移和细胞骨架重组的改变。EML4-ALK融合的患者有一些特殊的临床和病理特点,比如年龄较年轻,从不吸烟,进展期,低分化,固体和筛型组织,带有粘液和印戒细胞样特点等。
3、其他潜在的靶点
(1) ROS1融合突变
在约 1%~2% 的 NSCLC 中可检测到 ROS1 重排,导致了通路的连续激活。ROS1 是胰岛素受体家族的一种受体酪氨酸激酶。重排通常表现为CD74和SLC 34A2 ,这个重排在腺癌中的发生率为1%,克唑替尼被认为在携带ROS-1融合基因的肿瘤中具有活性。ALK和ROS1的激酶活性区域有70%的相似性,因此ALK的抑制剂很多是可以用于ROS1的治疗的。
(2) KRAS突变
KRAS 突变存在于15%~20%的NSCLC,存在于大约25%的肺腺癌中。KRAS 是RAS GTP酶家族的成员之一,可以通过Ras/Raf信号通路促进细胞的生长分化。该突变与吸烟史有明显的相关性。突变的KRAS与GTP的高亲和性限制了直接抑制KRAS的药物的研发和应用,暂时没有特异性的治疗药物。
(3) PIK3CA/AKT/mTOR通路突变
该通路突变包括PIK3CA、AKT、PTEN突变,这些突变出现在腺癌和鳞癌中,PIK3CA突变是致癌的,在这个群组中最常见,并可与腺癌的其它突变共存。PIK3CA/AKT/mTOR通路突变增加了mTOR抑制剂依维莫司的敏感性。然而,早期临床试验显示靶向这个通路的药物仅有部分反应。
(4) BRAF突变
BRAF属于MAPK 信号通路的丝氨酸苏氨酸蛋白激酶家族,约1%~3%的 NSCLC存在BRAF突变。在肺癌中,研究者检测到了BRAF 的多种突变位点,如 V600E(50%)、G469A(40%)、D594G(11%)。
(5) HER2突变
约 2%~4% 的NSCLC患者存在HER2突变,多数患者具有不吸烟腺癌的临床特征,最常见的突变类型是发生于20外显子的插入突变A775_G776ins YVMA,而在EGFR/KRAS/ALK均阴性的NSCLC穿刺标本中,HER2突变的发生率为6%。
(6) NTRK1和NRG1重排
近来,两个新的改变被发现:NTRK1和NRG1重排。NTRK1是编码高亲和性神经生长因子(TRKA蛋白)的基因。研究发现,NTRK1融合基因存在于3%的没有其它突变的腺癌患者中,而NRG1重排似乎主要存在于侵袭性腺癌。两个突变可能成为特异性的药物靶点。
在所有NSCLC分子靶向治疗靶点中,EGFR和ALK变异仍然是主要的两个类型,本文主要针对EGFR-TKIs和ALK-TKIs进行详细分析。
二、EGFR-TKIs药物
EGFR是HER/ErbB家族重要成员,它广泛分布于人体各类组织的细胞膜上,其结构分为胞外区、跨膜区及胞内区。
EGFR受体家族激活机制:
资料来源:The Oncologist August 15, 2002 vol. 7
当EGFR受体受到相应配体的作用后,可诱导受体形成同型或者异型二聚体,引起胞外结构发生构象变化,进而激活胞内区酪氨酸激酶,使其残基磷酸化,进一步激活下游信号通路,如MARK通路及PI3K通路等,最终导致肿瘤发生一系列生物学行为,如肿瘤的发生发展、增殖、侵袭及转移等。
EGFR酪氨酸激酶抑制剂(tyrosine-kinase-inhibitor,TKI)是一种小分子EGFR抑制剂,它们通过内源性配体竞争性结合EGFR,抑制酪氨酸激酶的活化,进而阻断EGFR信号通路,最终产生抑制肿瘤细胞的增殖、转移并促进肿瘤细胞发生凋亡等一系列生物学效应。
EGFR激酶区活化突变是EGFR-TKI的最重要的疗效预测因子,EGFR突变主要发生在18~21号外显子,其中19号外显子的缺失突变和21号外显子的L858R点突变是最常见的EGFR突变亚型,占所有突变类型的90%,称为EGFR基因的敏感突变。
第一个上市的EGFR-TKI是吉非替尼。一项比较吉非替尼和含铂双药方案在肺腺癌中疗效的Ⅲ期临床随机对照临床试验叫做IPASS研究 ,该研究开启了EGFR-TKI的肺癌精准医学时代,堪称肺癌靶向治疗的里程碑。自那以来,EGFR-TKI发展到了三代(表2)。
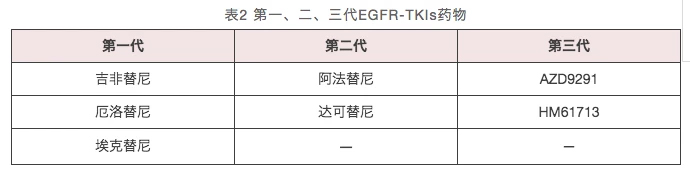
1、 第一代EGFR-TKIs
IPASS研究首次证明EGFR突变状态是肺癌患者对吉非替尼疗效的强预测因子,奠定了肺癌分子靶向治疗的基石。
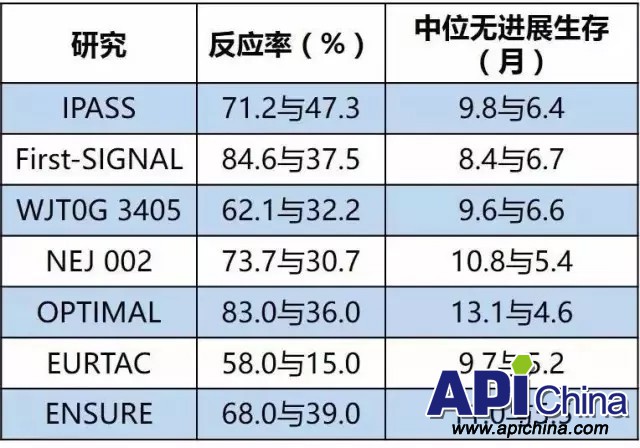
随后,多项大型Ⅲ期随机对照临床研究如First-SIGNAL、WJT0G3405、NEJ002、OPTIMAL、ENSURE和EURTAC相继证实,存在EGFR突变的肺癌患者接受EGFR-TKIs疗效显著优于传统化疗,一线治疗的中位PFS可达9~13个月,客观缓解率(objective response rate,ORR)为60%~85%,且不良反应及生活质量要显著优于化疗(表3)。
因此,一代EGFR-TKI已成为伴EGFR基因敏感突变阳性晚期非小细胞肺癌的标准一线治疗。
表3 一代EGFR-TKI治疗EGFR突变阳性患者的经典临床研究:
目前,国内的一代EGFR-TKI主要包括吉非替尼、厄洛替尼以及埃克替尼。吉非替尼于2005年中国上市,随即厄洛替尼、埃克替尼分别于2007年、2011年在中国上市。
总而言之,一代EGFR-TKI冶疗初期的EGFR基因突变阳性患者,ORR及PFS均显著优于标准化疗。而关于一代EGFR-TKI的研究均提示,三种靶向药物的疗效相似,但吉非替尼皮疹的发生率较低。
2、第二代EGFR-TKI
阿法替尼是第二代的靶向治疗药物,是针对ErbB家族的不可逆性阻滞剂,其可以选择且有效地阻滞ErbB家族受体(如EGFR,HER2,HER4)的信号传导以及ErbB的磷酸转移。与可逆性的EGFR酪氨酸激酶抑制剂(如吉非替尼和厄洛替尼)不同,二代EGFR-TKI能与ErbB受体网络形成共价结合,不可逆的、完全中断信号传导,从而带来持续且广谱的抗有丝分裂活性。
虽然在一代EGFR-TKI中,EGFR基因突变阳性患者可从中获得约10个月的中位缓解时间,但其获得性耐药问题仍有待解决,其最重要的分子机制是发生在EGFR基因20号外显子发生T790M二次突变。
而阿法替尼与ErbB家族受体不可逆结合的特性理论上会在一定程度上克服由T790M突变导致的获得性耐药。除了阿法替尼外,达克替尼(Dacomitinib)也是第二代EGFR-TKI中的另一代表性药物。
第二代EGFR-TKI再次验证了EGFR-TKI相比标准化疗的优势,同时细化了EGFR基因突变不同类型间的疗效差异,药物疗效似乎比一代药物更优。虽然在体外对突变患者有活性,但临床未能克服突变产生耐药性,毒副反应更加令人堪忧,因此,第二代的靶向药临床运用并不广泛。
3、第三代EGFR-TKIs
尽管一代、二代分子靶向药物都获得显著延长的中位缓解时间,但绝大部分患者最终会产生耐药,其中出现T790M二次突变占了所有耐药机制的50%~60%。
第三代EGFR-TKI是一种高度选择性、有效对抗EGFR-TKI获得性T790M耐药的新一代靶向治疗药物, AZD9291(Osimertinib)、HM6171(Olmutinib)等三代靶向药物横空出世,为克服TKI获得性耐药开启了全新的篇章。目前,除已经上市的两款三代EGFR-TKI药物外,国内外有大量三代药正处于开发之中。
(1) 国外情况
AZD9291于2015年11月中旬获美国FDA的加速批准用于T790M突变阳性转移性NSCLC的治疗,随后欧盟也加速批准了此项适应证,这些进展主要是基于2个Ⅱ期研究(AURA拓展研究及AURA2研究)以及AURAⅠ期拓展研究的积极数据。同样,AZD9291—线治疗EGFR突变阳性NSCLC显示出令人鼓舞的临床活性和良好的安全性。从目前的临床研究数据看来,三代靶向药物对一代TKI进展且伴T790M突变阳性患者的疗效显著,其中AZD9291是目前唯一获FDA批准上市的三代药物(表4)。
国外第三代EGFR抑制剂研发情况:
药品名称:Osimertinib (奥希替尼,AZD9291)
公司:阿斯利康
简介:口服突变选择性不可逆EGFR抑制剂,对EGFR-TKI敏感型及T790耐药突变有效,获批治疗EGFR T790突变阳性非小细胞肺癌。
阶段:2015年11月和2016年2月分别获得FDA和EMA上市批准。2016年3月日本批准,2017年获CFDA批准。
代表试验:AURA系列试验
实验数据:
有效性:AURA3 III期研究数据显示,Tagrisso (osimertinib,AZD9291)作为二线疗法相比含铂类药物的二联标准化疗可使无进展生存期显着延长5.7个月(10.1 vs 4.4个月)。AURA3研究中,基线时有34%的患者发生中枢神经系统转移。对于这部分患者,Tagrisso治疗组的PFS相比含铂类药物的二联标准化疗也有显着改善(8.5 vs 4.2个月)。
安全性:AURA3研究结果与之前的研究数据一致。Tagrisso 治疗组3级以上的药物治疗相关不良事件发生率为6%(n=16),铂类药物化疗组为34%(n=46)。Tagrisso组其他常见药物相关不良反应包括腹泻(29%),皮疹(28%);化疗组其他常见不良反应包括恶心(47%)和食欲不振(32%)。
药品名称:Olmutinib (奥莫替尼)
公司:韩美、BI、再鼎医药
简介:
Olmutinib于2016年5月获韩国MFDS批准上市,最初由韩美制药研发,2015年7月授权给勃林格殷格翰除韩国、中国和香港以外地区的全球研发和商业化权利,2015年11月再鼎医药获得中国地区(包括香港和澳门)的研发、生产及商业化权利。奥莫替尼用于治疗晚期或转移性T790M突变阳性非小细胞肺癌。
阶段:在韩国上市、再鼎2016年5月提交CFDA临床申请,BI已经放弃研发。
代表试验:HM-EMSI-101试验
实验数据:
有效性:I/II期试验中,ORR达62%,疾病控制率为91%。
不良反应:10%以上患者出现的药物相关不良反应包括脱皮、恶心、腹泻、皮疹、纳差、瘙痒、头痛等;多数不良反应为1/2度,容易控制或停药后缓解。2016年10月韩国2名患者死亡。
药品名称:Rociletinib Hydrobromide
公司:Celgene,Clovis
简介:
是由Avila公司原研的小分子化合物,其中Avila于2011年被新基收购。该药由新基和Clovis共同开发。口服靶向结合于敏感型EGFR基因突变以及T790M突变
阶段:
2015年7月FDA否决上市申请。Clovis撤回欧盟上市申请。
2016Q1放弃研发。
代表试验:TIGER系列试验
实验数据:
有效性:ORR为30%,低于开始公布的60%。剂量从500毫克提高到625毫克缺乏PK研究支持。
不良反应:恶心(34%),腹泻(23%)、糖耐量异常/高血糖症(52%),呕吐(17%),肌肉酸痛(11%),QTc间期延长(15%)。
药品名称:Nazartinib EGF816
公司:诺华
简介:
Nazartinib是诺华公司研发的第三代小分子口服EGFR不可逆抑制剂,目前处于2期临床试验中。类似于AZD9291,Nazartinib也是氨基嘧啶结构,共价结合于EGFR催化域ATP结合位点边缘的C797,对T790M突变有很强抑制活性。
阶段:临床II期
代表试验:NCT02108964
实验数据:
有效性:临床I期中,入组了132名T790M阳性NSCLC患者(排除有进展的脑转移),ORR44%,疾病控制率91%,中位PFS9.2月。
不良反应:腹泻(40%)、皮疹(39%)、皮肤瘙痒(32%)、皮肤干燥(23%)、口腔炎(23%)、疲劳(21%);估计最大耐受剂量小于225mg每天。
药品名称:Naquotinib(ASP8273)
简介:
Naquotinib是安斯泰来原研的治疗EGFR突变的非小细胞肺癌的药物。在日本开展的几起临床试验结果显示,Naquotinib能有效控制肿瘤缩小,且副作用较小
阶段:临床III期终止
代表试验:SOLAR试验
实验数据:
有效性:I期中,所有剂量ORR46.9%,中位PFS9.7月。安全性:副作用比AZD9291低。
2017年5月,Astellas 宣布终止公司 EGFR T790M 抑制剂 ASP8273 的 III 期 SOLAR 试验,试验将停止入组新患者。
从国外大型药企研发进度来看,其他的三代药物如CO-1686、BI1482694、EGF816、ASP8273等产品中,CO-1686(Rociletinib)于2015年7月被FDA否决上市申请。Clovis后来撤回欧盟上市申请,于2016年一季度放弃研发;诺华公司的EGF816目前正处于II期临床研究中;Olmutinib(HM61713/BI1482694)于2016年5月获韩国MFDS批准上市,最初由韩美制药研发,2015年7月授权给勃林格殷格翰除韩国、中国和香港以外地区的全球研发和商业化权利,2015年11月再鼎医药获得中国地区(包括香港和澳门)的研发、生产及商业化权利。但该药在2016年10月导致韩国2名患者死亡。Naquotinib(ASP8273)是安斯泰来原研的治疗EGFR突变的非小细胞肺癌的药物。在日本开展的几起临床试验结果显示,Naquotinib能有效控制肿瘤缩小,且副作用较小,但目前临床III期试验已经终止。
(2) 国内情况
国内市场来看,阿斯利康公司于2017年3月24日宣布,CFDA已正式批准第三代肺癌靶向药物泰瑞沙(甲磺酸奥希替尼片, AZD9291)用于既往经表皮生长因子受体(EGFR)酪氨酸激酶抑制剂(TKI)治疗时或治疗后出现的疾病进展,并且经检测确认存在EGFR T790M突变阳性的局部晚期或转移性非小细胞性肺癌(NSCLC)成人患者的治疗。
国内正在研发三代药物的企业及产品(表5)包括,艾森生物的艾维替尼目前处于临床II/III期试验阶段;贝达药业的BPI-7711和BPI-15086处于临床I期研究阶段;上海艾力斯处于临床I期研究阶段;江苏豪森的HS-10296处于国际多中心临床I/II期阶段,并获批CFDA临床批件。GMA204为第三代酪氨酸激酶抑制剂,分子量小,可以透过血脑屏障(BBB),在动物脑内药物分布比例高于EGFR的其他TKIs,对扩增的原发性肿瘤脑转移患者,疗效可能会优于现有已上市的酪氨酸酶抑制剂(TKIs)。GMA204由鸿运华宁和苏州韬略联合申报,在2016年12月批准临床。扬子江海雁药业的YZJ-0318目前处于临床1期,华东医药的迈华替尼也处于临床I期。总体来看,在当前AZD9291已经中国获批上市的情况下,国内企业只有临床效果优于AZD9291或者能够穿过血脑屏障的药物才具备较大的投资价值。
国内三代EGFR抑制剂研发情况
药品名称:艾维替尼AC0010
公司:艾森生物
简介:
口服突变选择性不可逆EGFR抑制剂,对EGFR-TKI敏感型及T790M耐药突变有效。
阶段:临床II/III期
代表试验:AC0010人体试验
实验数据:
有效性:初步结果,总体ORR为38.2%,T790M阳性的病人有效剂量范围内ORR62%。
不良反应:腹泻(44%)、皮疹(20%)、瘙痒(16%)、腹泻和皮疹的频率增加呈剂量依赖性
药品名称:
Alflutinib Mesylate AST2818
公司:上海艾力斯
简介:
甲磺酸艾氟替尼是一种潜在治疗晚期非小细胞肺癌(NSCLC)的第三代针对EGFR T790M突变的抑制剂。
阶段:临床I期
代表试验:临床前试验
实验数据:
对T790M耐药肿瘤展现良好的抑制肿瘤活性;该药在动物体内分布广泛,并可以通过血脑屏障。该药在临床前研究未发现心脏毒性,眼毒性和高血糖等不良反应,已展现良好的安全性。
药品名称:
BPI-7711/ BPI-15086
公司:贝达药业
简介:
一种潜在的治疗T790M突变的非小细胞肺癌(NSCLC)的第三代表皮生长因子受体(EGFR)抑制剂。
阶段:临床I期
实验数据:无。
药品名称:
HS-10296
公司:江苏豪森
简介:
HS-10296是豪森最新研发的治疗肺癌的第三代分子靶向药物,针对EGFR-T790M突变这个靶点。针对这个药物的治疗优势和良好的开发前景,豪森药业制定了国内国外同时申报的开发策略。目前已经在美国、台湾、韩国三个国家和地区的开展国际多中心临床研究。
阶段:
国际多中心临床1/2期,CFDA获批临床。
代表试验:临床前试验
实验数据:
据了解其在体内的活性是同类药品的2倍。由于它有独特的分子结构和独特的代谢途径,可以很好地规避严重皮疹和胃肠道毒性等不良反应,能解决现有药物的技术难题。
药品名称:
GMA204
公司:鸿运华宁&韬略生物
简介:
GMA204属于拥有自主知识产权的1.1类新药,其作为新一代的酪氨酸激酶抑制剂,分子量小,可以透过血脑屏障(BBB)。
阶段:临床I期
代表试验:临床前试验
实验数据:
在动物脑内药物分布比例高于EGFR的其他TKIs,对扩增的原发性肿瘤脑转移患者疗效可能优于已上市的TKIs。同时,其对EGFR的抑制作用比可逆性抑制剂更强,可作用于多种HER通道的受体,能同时抑制野生型的EGFR受体以及新突变EGFR受体(T790M变异),临床应用于EGFR突变的NSCLC,可针对化疗无效或者第一代EGFR抑制剂产生耐药性和产生新的T790M变异的晚期患者。
药品名称:
YZJ-0318
公司:扬子江海雁药业
简介:
独立开发的第三代表皮生长因子受体(EGFR)抑制剂,它可用于治疗在第一代EGFR抑制剂吉非替尼或厄洛替尼治疗后出现T790M耐药突变的非小细胞肺癌病人。
阶段:获批临床
代表试验:临床前试验
实验数据:
该候选药物能够选择性的抑制T790M耐药突变,在含有T790M突变的H1975肺癌移植瘤模型以及病人来源的含有T790M、L858R双突变的肺癌移植瘤模型中,均能够有效抑制肿瘤生长,同时,它对野生型EGFR作用很弱,在EGFR野生型的A431移植瘤模型中并不抑制肿瘤生长,提示YZJ-0318可能在临床上具有较小的皮疹、腹泻及间质肺炎的副作用。
药品名称:
迈华替尼
公司:华东医药
简介:
华东医药是国内第2家申报T790M突变药物的企业。迈华替尼片的临床申请2014年3月25获CDE受理,比艾维替尼晚了近半年时间,但是2014年10月即获批临床,只比艾维替尼晚了1个月。
阶段:临床I期
实验数据:无。
临床上针对EGFR基因敏感突变患者,应首选EGFR-TKI冶疗。目前,临床上的一代TKI疗效相当,以阿法替尼为代表的二代TKI对于突变阳性患者也显示出了很好的疗效,但是副作用较大。
第三代TKI克服了T790M获得性耐药,疗效卓越、安全性好,成为T790M阳性患者的首选治疗,但最佳的使用时机、次序以及新的耐药问题如C797S突变,仍需进一步探索,三代TKI是否能够取代前两代TKI成为一线治疗的探索也让我们拭目以待。
4、 EGFR-TKIs治疗NSCLC脑膜转移
非小细胞肺癌(non-small cell lung cancer, NSCLC)患者发生脑膜转移后,如不进行治疗,患者的生存时间仅为4~6周。尽管鞘内注射化疗药物在晚期NSCLC脑膜转移患者中显示出一定的疗效,但NSCLC脑膜转移患者的生存时间仍仅为12~14周。
肺腺癌是NSCLC脑膜转移患者主要的病理类型,约占84%~97%。其中43%~70.5%的NSCLC脑膜转移患者检测到EGFR敏感突变。有研究表明,经选择的EGFR敏感突变NSCLC患者应用EGFR酪氨酸激酶抑制剂(TKIs)治疗脑膜转移有效,并可延长患者的生存时间。其原因主要是由于EGFR-TKIs是小分子的靶向治疗药物,能透过血脑屏障。此外,EGFR-TKIs药物不良反应小,即使患者的美国东部肿瘤协作组评分差也可接受治疗。但仍需要进一步的临床试验来验证EGFR-TKIs治疗NSCLC脑膜转移患者的疗效。随着EGFR-TKIs的广泛应用,EGFR敏感突变患者的生存时间明显延长,但部分脑膜转移出现在EGFR-TKIs治疗之后,此类患者对于EGFR-TKIs的治疗效果欠佳,其治疗成为临床工作的难点。
三、 ALK-TKIs药物
1、 ALK靶点情况
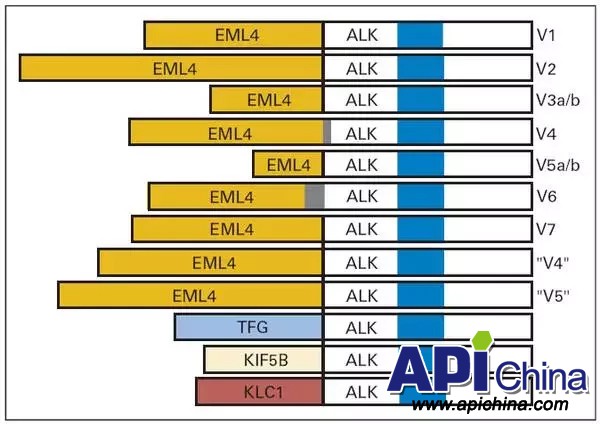
间变性淋巴瘤激酶(ALK)基因融合突变是非小细胞肺癌(NSCLC)常见的一种驱动基因,突变的形式有过量表达、形成融合基因,发生点突变等。ALK基因最初是1994 年在非霍奇金淋巴瘤中发现的,是由于染色体异位导致ALK 与核仁磷酸蛋白(NPM)融合所致。2007 年,Soda 等对非小细胞肺癌进行研究时发现了相同的ALK 基因,但此时却是因为染色体2p内小的倒位导致ALK和棘皮动物微管相关蛋白样蛋白4(EML4)融合。EML4基因可在多个位点发生断裂,与位于ALK第20外显子的胞内催化域相连,形成EML4-ALK融合基因。EML4断裂位点不同可以与ALK形成至少10种以上的EML4-ALK融合基因变体(Variant),变体1和变体3最常见,其他的融合伴侣基因还有KIF5B、TFG和KLC1等,目前发现有27种融合形式。EML4-ALK 融合型癌基因存在于高达3-5% 的NSCLC,可促进恶性生长及增殖。
非小细胞肺癌中ALK的重排形式:
肺癌患者的福音:非小细胞靶向药物前景如何?
中国非小细胞肺腺癌中ALK融合突变阳性的比例为4.3%,ALK阳性的非小细胞肺癌被认为是是一种独立的分子亚型,与其他驱动基因互相排斥,相对应的靶向药物与EGFR分子亚型完全不同。肺鳞癌患者ALK融合基因突变概率很低,有报道说1400个肺鳞癌患者里ALK融合基因的发生率为1.3%。相比 EGFR 来说,ALK 重排更可能见于特殊人群:吸烟少或不吸烟的年轻腺癌患者、组织学上多为印戒细胞者。女性具有ALK 重排的肿瘤,自然不会有EGFR 或KRAS 突变,且意味着是一种「癌基因依赖性」表型,即单一基因产物可导致恶性改变。
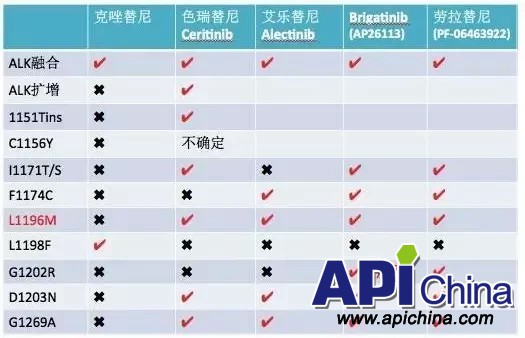
虽然目前有第一、第二代靶向药物,但是ALK阳性患者经过开始阶段的治疗敏感期后不可避免地出现获得性耐药。耐药机制包括ALK扩增,EGFR/HER2、HER2和HER3的上调,Ckit扩增,包括L1196M在内(如同EGFR中的T790M)的多种ALK 突变。因此,研制克服第一代、第二代ALK抑制剂弱点,开发出疗效好、副作用小的第三代ALK抑制剂治疗该类癌症具有潜在的市场价值。
2、现有药物
治疗ALK阳性非小细胞肺癌的创新药是生物制药公司研究的热点。第一代靶向药物是克唑替尼2011年,辉瑞研制的克唑替尼上市,2016年实现销售额达到1.45亿美元,预计2018年将达到8.3亿美元。克唑替尼耐药后可以使用第二代ALK抑制剂,主要有色瑞替尼(LDK378)、艾乐替尼(CH5424802)、Brigatinib(AP26113)和X-396。其中,诺华研制的色瑞替尼于2014年4月29日获FDA加速批准上市,2016 年其实现了9100 万美元的销售额。分析师预测这款药物的年销售峰值最终会达到大约3亿美元。罗氏和中外制药两家公司开发的艾乐替尼Alectinib,2014年在日本上市,2015年美国上市,2015年度的销售额为7130万美元。Ariad 的Brigatinib (AP26113) 一种新型的ALK和EGFR双重抑制剂,可强效抑制ALK的L1196M突变和EGFR的T790M突变。Brigatinib 已于2017年4月28日获得FDA批准上市,已被证实是目前第二代ALK抑制剂中最好的产品。
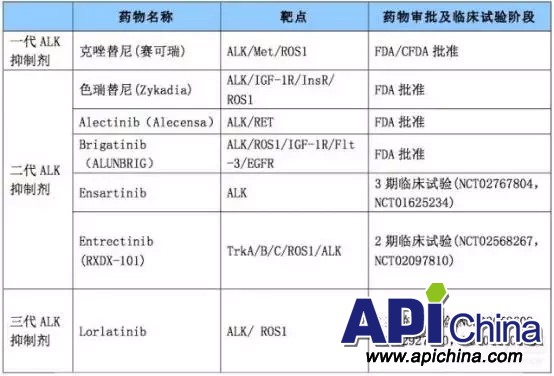
表6 第一、二、三代ALK-TKIs药物
(1) 药物详细介绍
克唑替尼分别于 2011 年、2013 年通过 FDA 和 CFDA 批准,用于 ALK 基因融合阳性晚期 NSCLC 患者的治疗。PROFILE1014 研究共纳入 343 例 ALK 阳性的 NSCLC 患者,其中分别接受克唑替尼治疗和一线化疗(顺铂 / 卡铂联合培美曲塞)。相比于一线化疗组,克唑替尼组同样显示了较长的无进展生存期 PFS(10.9 个月对比 7.0 个月)和较高的药物缓解率(RR)(74% 对比 45%)。
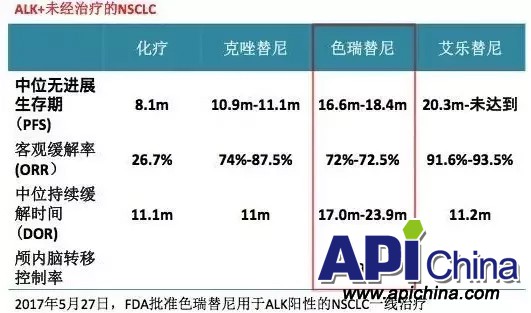
色瑞替尼于 2014 年被 FDA 批准,用于既往接受克唑替尼后病情进展或对克唑替尼不耐受的 ALK 阳性晚期 NSCLC 患者的治疗。2017 年 5 月底,FDA 批准色瑞替尼用于 ALK 阳性的晚期 NSCLC 患者的一线治疗。FDA 的快速审批是基于 Ⅲ 期 ASCEND-4 临床研究的结果,该研究表明未接受过其他治疗的病人接受色瑞替尼治疗后的中位 PFS 为 16.6 个月,而接受化疗的病人的中位 PFS 仅为 8.1 个月。色瑞替尼组的药物缓解率为 73%,高于化疗组的 27%。《NCCN 非小细胞肺癌临床实践指南》(2017.V5) 开始推荐色瑞替尼作为 ALK 阳性的晚期 NSCLC 患者的一线治疗(证据等级1)。
Alectinib 首先于 2014 年在日本上市,用于 ALK 阳性的的晚期 NSCLC 患者的治疗。在 2015 年年底,Alectinib 被 FDA 批准用于既往接受克唑替尼后病情进展或对克唑替尼不耐受的 ALK 阳性的晚期 NSCLC 患者的治疗。在 2017 年 ASCO 会议上,Alectinib与克唑替尼一线治疗的头对头的比较研究中,全面碾压了克唑替尼。《NCCN 非小细胞肺癌临床实践指南》(2017.V7)版本,正式确立 Alectinib 为 ALK 阳性的 NSCLC 患者一线治疗的地位(证据等级 1),而且推荐顺序排在了克唑替尼、色瑞替尼之前。若有脑转移,一线可考虑直接用色瑞替尼;若没有脑转移,可先用克唑替尼,以后再根据耐药原因选二三代靶向药。
X-396是由美国Xcovery研发的第二代ALK抑制剂,浙江贝达药业获得Ensartinib项目在中国市场的所有权益。Ensartinib II期临床部分数据表明,未用克唑替尼的患者总有效率为88%,PFS最长已经超过32个月,进展的一名患者为Met扩增。克唑替尼耐药的患者总有效率为77%(10/13),PFS最长的为29个月。克唑替尼和色瑞替尼耐药的患者总有效率为29%。
ALK的第三代靶向药物是劳拉替尼(Lorlatinib,PF06463922),该药主要靶向ALK和ROS1,可抑制克唑替尼耐药的9种突变,几乎可克服所有耐药突变,具有较强的血脑屏障透过能力,入脑效果较强,特别适合对其他ALK耐药的晚期NSCLC患者。研究发现ALK的L1198F突变也导致PF-06463922耐药。
(2) 临床设计及数据
表7 ALK抑制剂药物临床设计及数据
药品名称:
克唑替尼
获批时间及适应症:
克唑替尼分别于 2011 年、2013 年通过 FDA 和 CFDA 批准,用于 ALK 基因融合阳性晚期 NSCLC 患者的治疗。
临床试验设计:
PROFILE1014 研究共纳入 343 例 ALK 阳性的 NSCLC 患者,其中分别接受克唑替尼治疗和一线化疗(顺铂 / 卡铂联合培美曲塞)。
实验数据:
相比于一线化疗组,克唑替尼组同样显示了较长的无进展生存期 PFS(10.9 个月对比 7.0 个月)和较高的药物缓解率(RR)(74% 对比 45%)。
获批时间及适应症:
2016年适应证扩展到含有ROS-1基因突变的转移性NSCLC患者,克唑替尼成为第一个FDA批准用于ROS-1阳性NSCLC患者的治疗药物,也是唯一一个FDA批准针对ROS-1和ALK两类不同分子靶点的靶向药物。
临床试验设计:
克唑替尼用于治疗 ROS-1 阳性肿瘤患者的安全性及有效性在一项有 50 名 ROS-1 阳性转移性非小细胞肺癌患者参与的多中心、单组研究中得到评价。每天两次接受克唑替尼治疗的患者检测这款药物对他们肺癌肿瘤的作用。这项研究旨在检测总有效率,即肿瘤经历完全或部分缩小的患者百分比。
实验数据:
临床I期,50名受试者每日两次口服250mg克唑替尼,ORR为72%,包括3例(6%)CR和33例(66%)PR。中位起效时间为7.9周,中位反应持续时间为17.6个月,中位PFS为19.2个月。中位生存数据尚未达到,12月总生存率为85%。治疗的安全性数据和ALK阳性转移性NSCLC中报道一致。最常见不良反应是视力障碍、恶心、腹泻、呕吐、水肿、便秘、转氨酶升高、乏力、食欲下降、上呼吸道感染、头晕和神经病变,94%的不良反应为1-2度。
药品名称:
色瑞替尼(Ceritinib)
获批时间及适应症:
2014年4月抗癌药Zykadia(ceritinib)获FDA批准,用于经Xalkori(crizotinib)治疗后病情恶化或对Xalkori不耐受的间变性淋巴瘤激酶阳性(ALK+)转移性非小细胞肺癌(NSCLC)患者的治疗。
临床试验设计:
Zykadi的获批,是基于一项关键临床试验的数据。该试验在163例经Xalkori治疗后病情恶化或对Xalkori不耐受的ALK+NSCLC患者中开展。
实验数据:
该研究群体中,肿瘤转移的最常见部位为脑(60%)、肝脏(42%)、骨骼(42%)。研究数据表明,Zykadia治疗取得了54.6%的总响应率(ORR),平均响应持续时间为7.4个月。
获批时间及适应症:
2017年5月FDA 常规批准诺华色瑞替尼用于未经治疗的间变性淋巴瘤激酶(ALK)阳性转移性非小细胞肺癌(NSCLC)患者,ALK 的状态可通过 FDA 批准的一种检测产品进行确认。
临床试验设计:
这次的批准基于 III期ASCEND-4(NCT01828099)的数据,这是一项随机、多中心、开放式的阳性对照临床试验,受试者为既往未治疗的 ALK 阳性非小细胞肺癌患者。所有受试者在中心实验室以 VENTANA ALK(D5F3)检测证实有 ALK 重排证据。
ASCEND-4 将 376 名患者按 1:1 的比例配给日服一次的 750 mg 色瑞替尼(n = 189),直到疾病进展,或配给铂类-培美曲塞双药化疗(n = 187)。化疗组患者接受培美曲塞(500 mg/m2)+顺铂(75 mg/m2)或培美曲塞(500 mg/m2)+卡铂(AUC 5-6)治疗,每 21 天为一个化疗周期,每个周期的第一天进行用药,连续化疗 4 个周期,随后以培美曲塞进行维持治疗。
实验数据:
根据 BIRC 的评价,ASCEND-4 证明受试者的无进展生存期有改善,风险比为 0.55。估计的色瑞替尼治疗组中位数无进展生存期(PFS)为 16.6 个月,化疗组为 8.1 个月。色瑞替尼治疗组与化疗组证实的总有效率(ORR)分别为 73% 和 27%。色瑞替尼治疗组与化疗组的估计中位数持续缓解时间分别为 23.9 个月和 11.1 个月。总生存期数据尚不成熟。
在基线脑扫描有可检测中枢神经系统(CNS)损伤的患者中,根据 BIRC 神经系放射学家专家评估,色瑞替尼治疗组证实总颅内缓解率(ORR)为 57%,化疗组为 42%。
最常见副作用(ASCEND-4 中至少在 25% 的色瑞替尼治疗患者中发生)是腹泻、恶心、呕吐、疲劳、腹痛、食欲下降及咳嗽。38% 的色瑞替尼治疗患者中发生有严重副作用。12% 的患者发生导致色瑞替尼治疗中止的副作用。在 1% 或更多患者中发生的导致色瑞替尼治疗中止的副作用是肌酸酐升高、淀粉酶升高及脂肪酶升高。77% 的患者因副作用而导致剂量中断,66% 的患者剂量需要减少。色瑞替尼推荐剂量为日服一次 750 mg,至少餐前 1 小时或餐后 2 小时服用。
药品名称:
Alectinib
获批时间及适应症:
2014年在日本上市,2015年12月美国FDA批准艾乐替尼胶囊Alecensa(alectinib)用于治疗晚期(转移性)ALK阳性非小细胞肺癌,适用于经另一种治疗药物-克唑替尼治疗后恶化或不对其耐受的患者。
临床试验设计:
该批准基于两项多中心、单臂、开放性临床研究,总有效率分别为38%、44%,中位缓解时间分别为7.5个月、11.5个月,中枢神经系统的总有效率为61%且中位缓解时间为9.1个月。推荐剂量为alectinib 600mg bid 与食物同服。最常见副反应为乏力、便秘、水肿及肌肉痛,最严重的副反应为呼吸困难。
实验数据:
临床研究数据在两个促成Alecensa批准的其中一个研究中,一天两次用药,使87名参与者中的38%肺肿瘤缩小,这一效果持续了平均7个半月。在第二份研究中(也是由基因泰克资助),138名患者中44%的患者肿瘤缩小了,这一效果持续了平均大约11个月。所有参与研究的患者之前都用过克唑替尼,但是已经无效了。
两个研究也都测试了Alecensa(化学上称alectinib 艾乐替尼)对已经蔓延到大脑的肿瘤的效果,在这类病人中,这种肿瘤转移经常发生。根据FDA的结果,两项研究中61%的患者脑部肿瘤缩小或消失了,效果平均持续大约九个月。
获批时间及适应症:
2016年10月FDA授予其肺癌新药Alecensa(alectinib)一线治疗成人晚期ALK阳性非小细胞肺癌(NSCLC)突破性药物资格。
临床试验设计:
ALEX 临床研究是一项随机、开放的 Ⅲ 期临床试验,纳入了 303 例未经治疗的 ALK 阳性的 NSCLC 患者,其中包括中枢神经系统无症状进展的患者,随机分到克唑替尼组(250 mg/Bid)和 Alectinib 组(600 mg/Bid)进行治疗。比较了alectinib和克唑替尼作为一线疗法的疗效和安全性。
实验数据:
在经过 17.6 个月(克唑替尼)和 18.6 个月(Alectinib)的中位随访时间后,Alectinib 组 12 个月时的 PFS 的比例高达 68.4%,而克唑替尼组的 PFS 的比例只有 48.7%。并且在 24 个月的时候,Alectinib 组的 PFS 的比例仍保持在 60% 左右,而克唑替尼组就仅有 20% 左右。2017年ASCO会议上公布Alectinib中位PFS为25.7个月,克唑替尼为10.4个月。12 个月时,Alectinib 组的中枢神经系统进展累积发生率仅为 9.4%,而克唑替尼组则为 41.4%。Alectinib 组的药物缓解率为 82.9%,也高于克唑替尼组的 75.5%。安全性方面,3~5 级不良反应在 Alectinib 组为 41%,低于克唑替尼组的 50%。
药品名称:
Brigatinib
获批时间及适应症:
2017年4月brigatinib获FDA批准上市。适应症是克唑替尼耐药的ALK阳性的非小细胞肺癌患者,剂量每天180mg。
FDA是基于一个数据非常出色的二期临床试验批准Brigatinib上市。
临床试验设计:
临床试验代号ALTA临床设计:招募222位ALK阳性而且使用克唑替尼之后耐药的晚期非小细胞肺癌患者,随机分成两组,A组患者每天口服90mg;B组患者前七天每天口服90mg,接下来每天口服180mg,,中位随访时间8.3个月。
Ariad已启动代号为ALTA 1L的III期研究,头对头比较Brigatinib和克唑替尼用于既往未接受过ALK抑制剂治疗的局部晚期或转移性ALK+NSCLC的安全性和疗效。
实验数据:
A组的客观缓解率是45%,1名患者肿瘤消失;B组的客观缓解率是55%,5名患者肿瘤完全消失。AB两组的疾病控制率都超过了80%。尤其值得一提的是,对于脑转移的患者来说,A组42%的患者颅内肿瘤有明显缩小,而B组有67%的患者颅内肿瘤缩小。
最常见的治疗相关突发不良事件(TEAEs≥ 25%)包括恶心(40%)、腹泻(38%)、咳嗽(34%)、血肌酸激酶升高(30%)、头痛(27%)、疲劳(27%)。3级以上且发生率≥ 5%的TEAEs包括血肌酸激酶升高(9%)、高血压(6%)、肺炎(5%)。
药品名称:
X-396
获批时间及适应症:
X-396是由Xcovery公司新药设计大师梁从新博士研发的第2代ALK抑制剂,被美国列为“抗癌登月计划”。
临床试验设计:
X-396正在全球70多家医院开展III期临床实验,贝达药业在中大肿瘤防治中心等同步展开临床试验。X-396属于第二代的ALK抑制剂,在I、II期临床中对ALK阳性非小细胞肺癌有良好的疗效和安全性,随着大规模III期临床研究的开展,X-396将成为更具市场潜力的第二代靶向药。
实验数据:
X-396的II期临床95例患者表明:1、X-396治疗克唑替尼(辉瑞)耐药患者有很好的疗效。2、 X-396可有效治疗脑转,ALK阳性患者脑转移的比例很高,克唑替尼(辉瑞)或色瑞替尼(诺华)耐药且治疗失败的脑转移患者,采用x-396治疗脑膜转患者仍有约60%的客观缓解率。3、x-396也治疗其他二代ALK抑制剂(如色瑞替尼(诺华)和阿法替尼)治疗后进展的患者。4、X-396的耐受性很好,毒副作用轻微,可随着食物的消化过程消失。X-396的皮疹和其它靶向药不同,只要暂停几天或减量即可。5、X-396对cmet阳性患者也有一定疗效。6、目前X-396正和克唑替尼(辉瑞)对照一线治疗ALK阳性患者的III 期试验,证明 X-396是很有效的药物,其优势是相对于其它靶向药x-396副作用很低,患者耐受性更好,是目前比较理想的二代靶向药。
药品名称:
劳拉替尼
获批时间及适应症:
Lorlatinib 是一个第三代 ALK/ ROS1 抑制剂,低于纳摩尔的剂量就能有效抑制 EML4-ALK 基因重排,其独特的大环结构也使其有更好的血脑屏障穿透能力,目前也是唯一一个能克服 ALK-G1202R 耐药位点的 ALK 抑制剂。
临床试验设计:
Lorlatinib 于 2017 年 4 月获 FDA 突破性疗法认法,用于 ALK 阳性的 NSCLC 患者的二线治疗。目前也有和克唑替尼比较用于 ALK 阳性一线治疗转移 NSCLC 患者的临床试验(NCT03052608)。
II期研究纳入了转移性ALK 晚期非小细胞癌NSCLC患者,至少使用过一种TKI抑制剂。
实验数据:
根据辉瑞 2016 年 6 月 5 日在 ASCO2016 上公布的I/II期临床研究数据显示,在 41 例患者接受 lorlatinib 治疗的 ALK+ 患者中总应答率为 46%,3 例患者实现完全应答,16 例患者实现部分应答(95% CI:31-63),中位 PFS 为 11.4 个月(95% CI:3.4-16.6)。
最常见的治疗相关不良事件为高胆固醇血症(69%)和外周性水肿(37%)。最常见的治疗相关的3级以上不良事件为高胆固醇血症(11%)。未见患者因为治疗相关不良事件而终止治疗。
(3) 耐药突变
尽管大多数患者最初受益于克唑替尼,但肿瘤通常在治疗后 1 年内再次进展。目前较为明确的耐药机制主要分为2大类:一是 ALK 本身的变化,ALK 基因扩增或者 ALK 激酶结构域的继发耐药位点;二是旁路途径的激活,包括其他受体酪氨酸激酶的通路或细胞下游的信号通路。
此外血脑屏障的存在是不是克唑替尼的原发性耐药机制一直备受关注,约有 50% 的患者在接受克唑替尼治疗期间会发生中枢神经系统进展。二代或者三代 ALK 抑制一直在这些方面进行升级和改善。
虽然 Brigatinib、Ensartinib(x-396)和 Lorlatinib在临床试验里显示了对 G1202R的有效性,但 G1202R突变在除 Lorlatinib外的 ALK抑制剂耐药患者中均有存在(表8)。
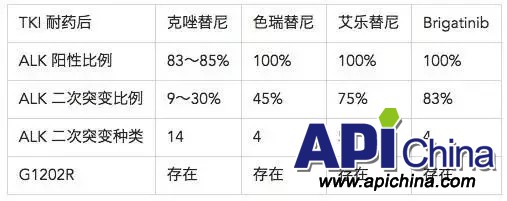
表8 ALK融合基因阳性和二次突变情况

表9 ALK常见变异的靶向药敏感性
(4) 药物数据对比
表10 不同 ALK 抑制剂一线治疗疗效对比
表11 ALK-TKIs药物基本信息
药品名称:
克唑替尼Crizotinib
研发公司:辉瑞
分子大小:450
骨架核心:单氨基吡啶
服用剂量:250mg,2次/天
FDA批准:一线
药品名称:
色瑞替尼ceritinib
研发公司:诺华
分子大小:558
骨架核心:二氨基吡啶
服用剂量:750mg,1次/天
FDA批准:一线
药品名称:
艾乐替尼aletinib
研发公司:罗氏
分子大小:483
骨架核心:四环吲哚
服用剂量:300mg,2次/天
FDA批准:二线
表12 ALK-TKIs一线用药数据
药品名称:
克唑替尼
ORR(有效率):75.5%
PFS(耐药):10.4月
脑转移ORR:26%
重度AE(毒副反应):50%
药品名称:
色瑞替尼ceritinib
ORR(有效率):72.5%
PFS(耐药):16.6月
脑转移ORR:46.3%
重度AE(毒副反应):78%
药品名称:
艾乐替尼
ORR(有效率):82.9%
PFS(耐药):25.7月
脑转移ORR:69%
重度AE(毒副反应):20%
药品名称:
X-396(eXalt2)
ORR(有效率):87%(入组15人)
PFS(耐药):PFS尚不成熟
脑转移ORR:69%
重度AE(毒副反应):20%
表13 ALK-TKIs二、三线用药数据
药品名称:
色瑞替尼ceritinib
试验设计:克唑替尼耐药后
有效率:56%
PFS:6.9月
脑转移ORR:36%
药品名称:
艾乐替尼Aletinib
试验设计:克唑替尼耐药后
有效率:44%
PFS:11.2月
脑转移ORR:61%
药品名称:
布加替尼brigatinib
试验设计:克唑替尼耐药后
有效率:55%
PFS:15.6月
脑转移ORR:67%
药品名称:
X-396(eXalt2)
试验设计:克唑替尼耐药后
有效率:71%
PFS:PFS尚不成熟
脑转移ORR:未知
药品名称:
劳拉替尼
试验设计:>=1种TKI耐药后
有效率:46%
PFS:11.4月
脑转移ORR:未知
总体来看,相较于克唑替尼,二三代ALK抑制剂可抑制大多数克唑替尼耐药的ALK突变;穿透血脑屏障的能力比克唑替尼强,颅内病灶控制好;继发耐药原因与克唑替尼相似,主要为ALK二次点突变、旁路激活和其他。二代药物色瑞替尼已经获批作为一线用药,艾乐替尼、Brigatinib均有可能成为一线用药。在研二代药X-396发表数据不多,初步临床数据显示,作为一线用药有效率87%,CNS 响应率为 69%,数据十分突出,但是临床入组人数较少,疗效的优势需要进一步通过临床试验确认。
四、 小结
NCSLC患者使用各种分子靶向药后,会产生耐药,面对新出现的耐药,各种新的靶向药也一代代开发出来,NCSLC用药市场也不断扩大。国内针对EGFR T790M耐药突变开发第三代TKI药物的企业甚多,竞争十分激烈。在当前AZD9291已经中国获批上市的情况下,国内企业只有临床效果优于AZD9291(疗效更好,副作用更低)或者能够穿过血脑屏障的药物才具备较大的投资价值。目前,从了解到的信息可知,能够穿过血脑屏障的在研药物包括上海艾利斯的AST2818、韬略生物和鸿运华宁共同研发的GMA204,这些药物值得关注。
对于ALK-TKI来说,NSCLC的一线用药方面,目前艾乐替尼疗效最佳。《NCCN 非小细胞肺癌临床实践指南》(2017.V7)已经正式确立 Alectinib 为 ALK 阳性的 NSCLC 患者一线治疗的地位。二线用药方面,2017年4月刚上市的Brigatinib是目前市场上最好的二线用药。贝达药业和Xcovery研发的Ensartinib (X-396)初步数据显示,该药作为一线或二线用药,有效性数据十分抢眼,目前正在临床III期研究,未来可能在二线用药上超越Brigatinib。三线用药方面,目前仅有辉瑞的第三代ALK抑制剂劳拉替尼(Lorlatinib),该药可抑制克唑替尼耐药的9种突变,具有较强的血脑屏障透过能力,入脑效果较强,特别适合对其他ALK耐药的晚期NSCLC患者,未来具有较好的市场前景。Brigatinib、Lorlatinib和Ensartinib一线PK克唑替尼的三期临床试验正在进行,在接下来的2-3年里,ALK抑制剂领域将会有效果更好的一线药物出现。
随着人们对分子遗传学认识的不断增强,NSCLC 被细分为各种不同的分子亚型,并由此诞生了各类分子靶向治疗药物。靶向药的应用,明显改善了 NSCLC 患者的预后。非小细胞肺癌不再被视为一个疾病,它是一类由不同分子亚型构成的异质性疾病。对非小细胞肺癌患者进行组织活检来测定 EGFR 和 ALK 状态已经是一个重要的诊疗步骤。
虽然本综述仅仅论述了分子靶向治疗和相关的癌驱动基因,市场上还有很多其他的靶向治疗方案。比如贝伐单抗(一种抗血管生成剂)联合紫杉醇 + 铂类治疗可以改善患者总生存期。另一个重要的治疗手段是分子调节免疫应答。随着肿瘤免疫生物学研究的不断推进,新的免疫疗法正在飞速发展。比如免疫检查点药物PD-1抑制剂Keytruda被FDA批准同时作为单药和联合疗法用于转移性非小细胞肺癌的一线治疗。另外,FDA已批准Opdivo用于二线治疗NSCLC,Tecentriq用于接受含铂化疗治疗期间或治疗后病情进展、以及接受靶向疗法(若肿瘤中存在EGFR或ALK基因异常)治疗失败的转移性非小细胞肺癌。